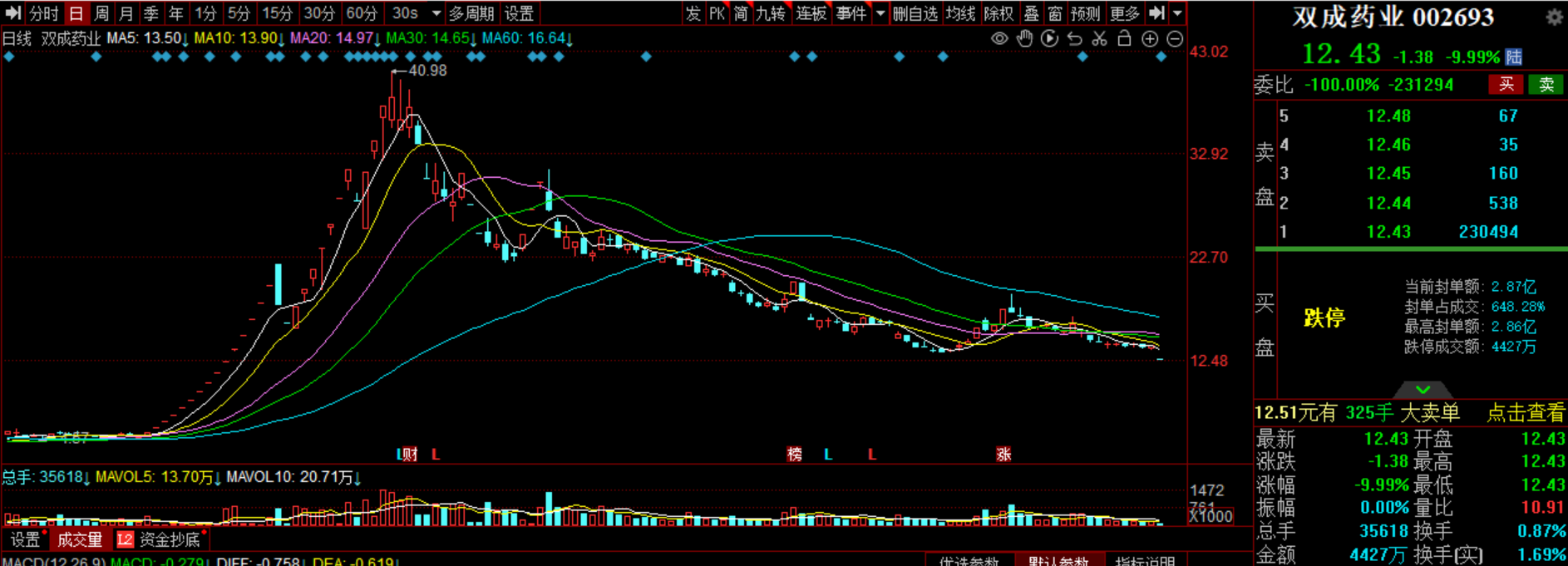
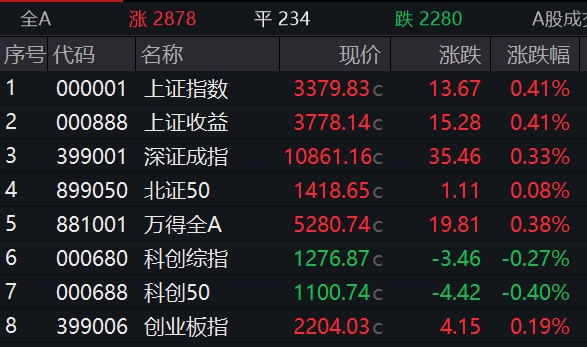
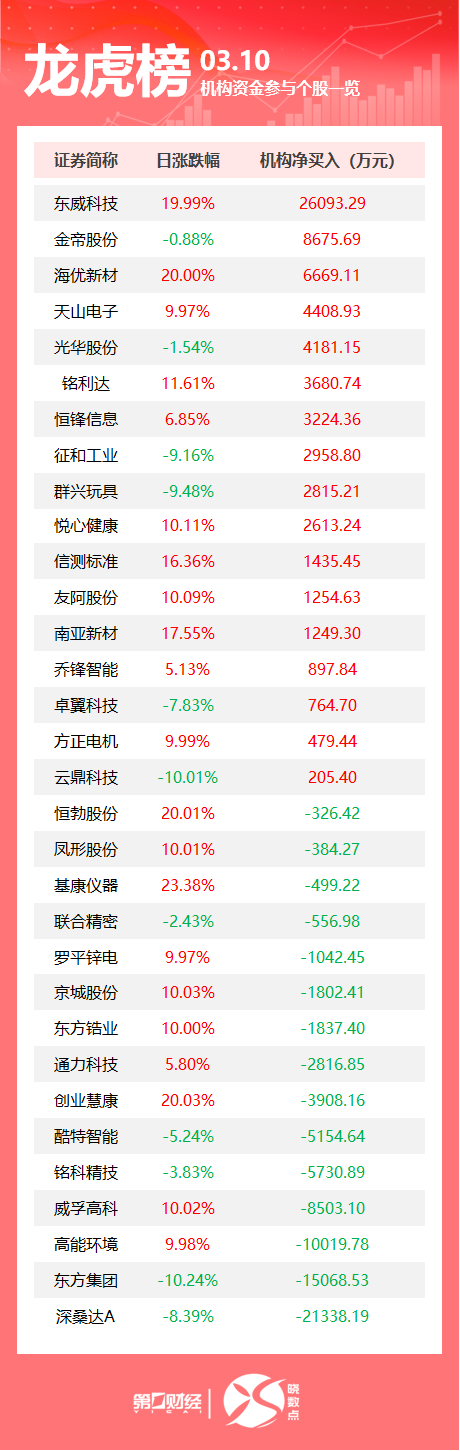
国产九价HPV疫苗申请上市时间近了!万泰生物三期临床试验主要结果揭盲
近期以来,关于国产九价HPV疫苗何时会申请上市,成为市场焦点。
4月10日下午,万泰生物(603392.SH)发布了公司九价HPV疫苗三期临床试验揭盲结果的公告。
公告介绍称,近日,万泰生物九价HPV疫苗已按计划完成V8访视的标本检测,主要分析数据集中累积到方案预定的12月持续性感染终点事件数,已完成揭盲并取得主要数据初步分析结果。公司收到了第三方统计公司交付的主要数据初步分析结果,主要结果符合预期。
万泰生物是国产企业中首家上市二价HPV疫苗的。在公司二价HPV疫苗基础,九价HPV疫苗覆盖HPV16/18/31/33/45/52/58七种高危型和HPV6/11两种低危型,后者于2017年11月6日获得药物临床试验批件 。
万泰生物九价HPV疫苗三期临床试验采用了多中心、随机、双盲、二价HPV疫苗对照的设计,由江苏省疾病预防控制中心(江苏省公共卫生研究院)作为组长单位,在全国5个试验现场共同开展。本试验共设置12次访视(V1-V12访视)。
本次九价HPV疫苗三期临床试验揭盲获得的数据仅为截至V8访视的部分主要结果,这是否具备申报上市条件?
2023年7月,国家药监局药品评审中心发布《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》,其中对于迭代疫苗上市研究终点做出了优化。企业基于第一代疫苗研发平台开发的疫苗,可采用12月持续性感染终点进行申报上市。
在这份指导原则下,由于万泰生物已有二价HPV疫苗在售,九价HPV疫苗作为迭代疫苗获批上市时间可以缩短。
万泰生物此次在公告中表示,九价HPV疫苗三期临床试验共设置12次访视(V1-V12访视),其作为迭代疫苗拟采用12月持续性感染终点(12 月持续性感染终点事件数在V8访视时累积达到)进行注册申报,但三期临床试验仍需按方案设计完成后续研究并补充完整报告提交CDE(即国家药监局药品评审中心)。
万泰生物表示,本次九价HPV疫苗三期临床试验揭盲获得的数据仅为截至 V8 访视的部分主要结果,后续还需根据方案及统计分析计划的规定开展全面深入分析,并完成临床试验总结报告。公司正同步开展新药注册申请资料的撰写工作,并将积极开展与药监部门沟通申报事宜,在提交新药注册申请后,还需在国家相关部门的技术审评、临床试验数据现场核查、研制现场核查、生产现场核查等程序通过后,方能获得药品注册批件。
当前,在国内市场,二价HPV疫苗市场竞争已近乎白热化。万泰生物的二价HPV疫苗是在2019年12月30日获得《药品注册批件》,并于2020年5月正式上市销售。上市后,这款疫苗销售迅速放量,并一度助推公司业绩增长。然而从2023年上半年起,该疫苗的收入开始出现下滑。万泰生物2023年归属于母公司的净利润为12.48亿元,同比下降73.65%,原因之一是二价HPV疫苗销售不及预期。
万泰生物二价HPV疫苗销售承压背后,进口九价HPV疫苗正在加大力度抢占市场。目前国内获批上市的九价HPV疫苗仅有跨国药企默沙东的九价人乳头瘤病毒疫苗(酿酒酵母)。
2022年8月,默沙东九价HPV疫苗宣布扩龄接种,适用人群从原来的16岁到26岁女性变为9到45岁女性。2023年9月份,默沙东九价HPV疫苗男性适应证上市申请获中国药监局受理。2024年1月,该九价HPV疫苗又新增9岁至14岁二剂次接种程序。2024年3月,默沙东全球宣布,计划开展九价HPV疫苗单剂次接种方案的临床试验。
而万泰生物九价HPV疫苗一旦上市的话,如何与进口九价疫苗形成差异化竞争,后续也值得观察。
特斯拉德国柏林工厂断电停产 员工被紧急疏散
有媒体报道称,断电的原因可能是气候活动人士对一处电线杆纵火。目前工厂的员工已被紧急疏散。当地时间3月5日,美国电动汽车制造商特斯拉公司位于德国柏林东南部的超级工厂因断电停止生产活动。有媒体报道称,断电的原因可能是气候活动人士对一处电线杆纵火。目前工厂的员工已被紧急疏散。据悉,除工厂外,临近的埃尔克纳市和柏林部分地区也都受到了停电影响。0000道指再创收盘历史新高,微软、Alphabet揭榜,财报季进入高潮
谷歌母公司Alphabet主营广告业务营收655亿美元,不及分析师预期的658亿美元,其中核心搜索业务营收480.2亿美元,低于分析师预期的481.5亿美元。*三大指数涨跌互现,道指续创新高*微软云业务增速略不及市场预期*UPS预测2024年营收低于预期当地时间1月30日(周二),美股三大指数小幅低开后走势分化,纳指呈现单边下跌走势,直至尾盘有所回升,标普500指数则全天横盘震荡。0000蓝思科技技术减碳:内减碳存量,外加新能源增量
蓝思科技计划按每年万元产值能耗下降5%,有序推进“十四五”节能减排规划。2022年,南方电网在蓝思科技松山湖园区建设了一个总容量为53MW(兆瓦)/105MWh(兆瓦时)的用户侧智慧用能项目储能,平均每天移峰填谷约10万度电,是目前全国单体容量最大的用户侧磷酸铁锂电化学储能项目。这是蓝思科技布局的一个光伏、储能一体化的减碳新项目。0000董事长总经理带头减持后,三一重工罕见公布8月经营数据
随着国内工程机械行业周期筑底,出口数据下半年首次转正,三一重工将交出怎样的年度业绩表现,或许才是股价走势的关键。三一重工(600031.SH)多名董监高抛出金额超亿元减持计划股价大跌后,上市公司罕见发布了月度经营数据。0000万亿风投成新领域新赛道“加速引擎”,上海将打造国际风险投资高地
2022年股权投资行业发起投资的频次下降,投资领域则进一步聚焦硬科技,半导体、清洁技术、新能源汽车等领域持续升温。当前,我国风险投资高度集聚,北上深三地私募股权投资类基金(包括私募股权投资基金和风险投资基金)数量和管理基金规模,分别占全国的50.7%、52.6%,均超过一半。0000