1类创新药获批数从“腰斩”回归较高水平,这类新药占四成
国内创新药获批数量在经历2022年罕见的“腰斩”之后,在2023年重新回归历史较高水平,为40个。其中,有15种创新药通过“快速通道”获批,有近四成创新药在当年纳入了基本医保目录,表明药审和医保资源均进一步向具有明显临床价值、满足临床急需的新药倾斜。
2月4日,国家药监局官网发布《2023年度药品审评报告》(下称“报告”),这是近五年来,药品审评年度报告首次于次年上半年公布。5个月前,国家药监局刚刚发布《2022年度药品审评报告》,而此前几年,药审报告均于第二年6月左右发布。
根据报告,2023年全年批准上市的1类创新药有40个,接近于2022年获批数(21款)的两倍。而在2019、2020年和2021年三年里,我国1类创新药获批数分别为12、20和47个。由此计算,近五年来,我国获批的1类创新药达到140个,并总体呈增长趋势。
1类创新药代表了我国药品注册分类中药物创新的最高水平。以化学药品新药为例,根据《化学药品注册分类改革工作方案》,1类药为境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。在生物制剂方面,根据国家药监局2017年对《关于调整进口药品注册管理有关事项的决定》做出的政策解读,治疗用生物制品创新药是指未在国内外上市销售的治疗用生物制品。
第一财经梳理发现,在去年获批的40个1类创新药中,除了五款中药,其余均为化药和生物制剂。从适应证来看,去年获批的创新药覆盖了失眠障碍、控制饮食和降低血脂等近年来社会需求有所增多的治疗领域。此外,抗肿瘤新药占比仍近4成,包括用于转移性非小细胞肺癌(NSCLC)成人患者的一线治疗药物,以及用于治疗复发或难治性淋巴瘤、宫颈癌、多发性骨髓瘤等恶性肿瘤新药。
此前,抗肿瘤新药研发靶点扎堆、同质化高的问题已引起药审部门持续关注并多次在年度药审报告中提出警示。去年国家药监局发布《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》,明确“某药品获附条件批准上市后,原则上不再同意其他同机制、同靶点、同适应证的同类药品开展相似的以附条件上市为目标的临床试验申请”,拟进一步将热门靶点的重复性创新将进一步排除在药品加速审批之外。
在此背景下,去年获批上市的抗肿瘤新药多为临床急需种类,并在药物机制上涵盖了CAR-T疗法、CD20抗体等全球药物研发竞赛的热门赛道。
“当前新一轮技术变革加快发展,围绕新机制、新靶点药物的基础研究和转化应用不断取得新突破,以细胞治疗、基因治疗、小核酸药物等为代表的新一代疗法日渐成熟。”报告在前言中指出,生物医药产业进入新阶段,面对新发展阶段,药审中心要持续深化药品审评审批制度改革,完善加快上市注册程序,加快临床急需新药好药审评审批。
“加快上市注册”的渠道有四条,也即附条件批准、优先审评审批、突破性治疗和特别审批。为尽快填补未被满足的临床需求,在去年审批通过的40个创新药中,有15个是通过前述四种快速通道获批上市的,包括了绝大多数抗肿瘤新药。
比如,伊基奥仑赛注射液为全球首个全人源靶向BCMA的CAR-T细胞治疗产品;伯瑞替尼则是针对METex14罕见突变晚期肺癌患者的靶向药物,此前亦存在国内患者的用药空白。
多款抗肿瘤药物之外,去年通过快速通道获批的新药还包括四款国产新冠治疗药物、国内首款用于治疗青少年重度斑秃的药物等。
药盾公益基金理事解奕炯在去年接受媒体采访时曾表示,多年前,一种创新药从审评到最终患者用上药,平均周期大概5年,纳入医保需要5~8年的时间,加快审评审批速度后,一些创新药物能够更快进入临床使用。
如果说药品审评审批是药品研发上市的“最后一公里”,那么新药纳入医保则是患者可及的“第一公里”。去年,在创新药审评审批提速的同时,当年上市的创新药进入“国谈”并最终谈判成功的比例也明显增加。
2023年,国家医保药品目录共新增126种药品,其中肿瘤用药21种。据记者归纳,新增“国谈药”中,至少有15种为当年获批的新药。当年获批并纳入医保的新药绝大多数为高价高值药和独家产品,其中12种药企选择以“价格保密”的方式进入医保。而在没有进入当年医保目录的新药中,除了“百万抗癌药”CAR-T疗法外,多为8月之后获批上市的新药,错过了当年“国谈”的时间。
除了创新药,2023年,无论是我国药物加快审批通道还是医保目录调整,也都进一步向儿童用药、罕见病药物方面倾斜。
根据国家药监局药审中心于去年上半年发布的《药审中心加快创新药上市许可申请审评工作规范(试行)》的通知》,鼓励儿童用药、罕见病用药创新研发进程,加快创新药品种审评审批速度。
报告显示,2023年批准罕见病用药45个品种(未包括化药4类罕见病用药),其中15个品种(33.3%)通过优先审评审批程序得以加快上市,1个附条件批准上市。
记者注意到,在2023年获批的罕见病用药中,已有一些药物在当年12月中旬被纳入新版国家医保目录。比如,2023年4月28日获批上市、9月流通销售、用于治疗“3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童患者”的硫酸氢司美替尼胶囊。换言之,该款药物从获批、上市流通到纳入医保,仅仅经历了8个月的时间。
而在儿童用药方面,2022年儿童用药批准数量为66个,创历史新高,但该数值在次年再获突破。报告显示,2023年,全年批准儿童用药产品92个品种。
对于2024年药审工作重点,报告提到了四方面内容:其一,全面提高科学审评质量和效率,加强现代化审评体系建设,深入推进审评标准与国际接轨;其二,全力推动中药审评审批机制改革,促进中药传承创新发展;其三,科学高效开展化学仿制药上市、一致性评价以及补充申请相关审评工作,服务国家发展战略;其四,促进生物医药产业创新发展,聚焦前沿技术领域,全面加在服务国家发展战略。
央行年内二度全面降准,“一箭三雕”稳经济
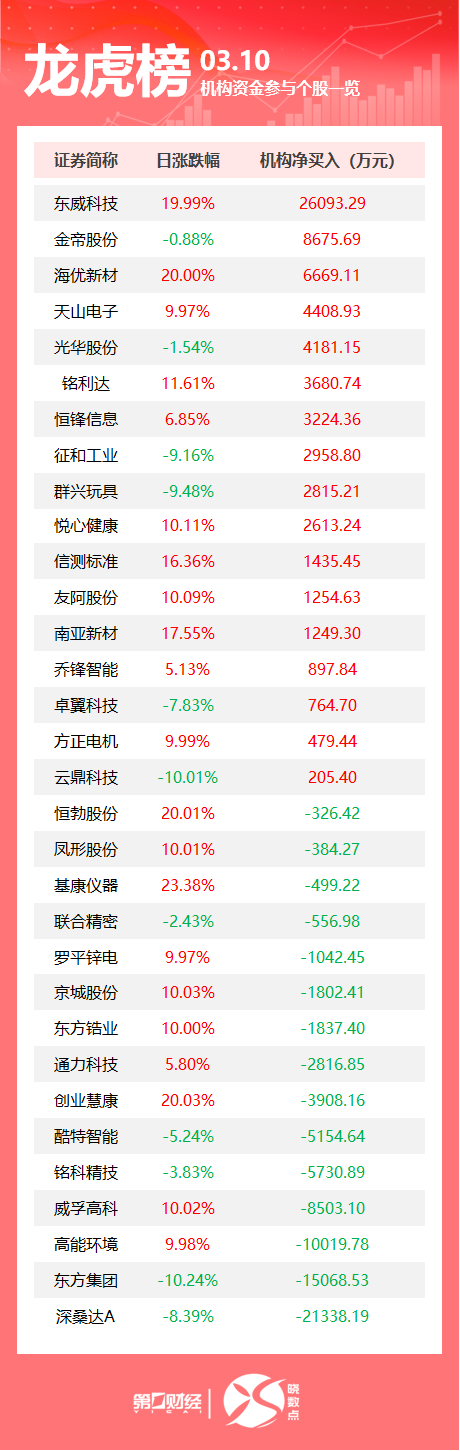
释放流动性5000亿元,降低银行资金成本,助力实体经济企稳时隔6个月,全面降准再次落地。9月14日,中国人民银行决定于15日下调金融机构存款准备金率0.25个百分点(不含已执行5%存款准备金率的金融机构)。本次下调后,金融机构加权平均存款准备金率约为7.4%。0000机构今日买入这13股,抛售沃尔核材5943万元丨龙虎榜
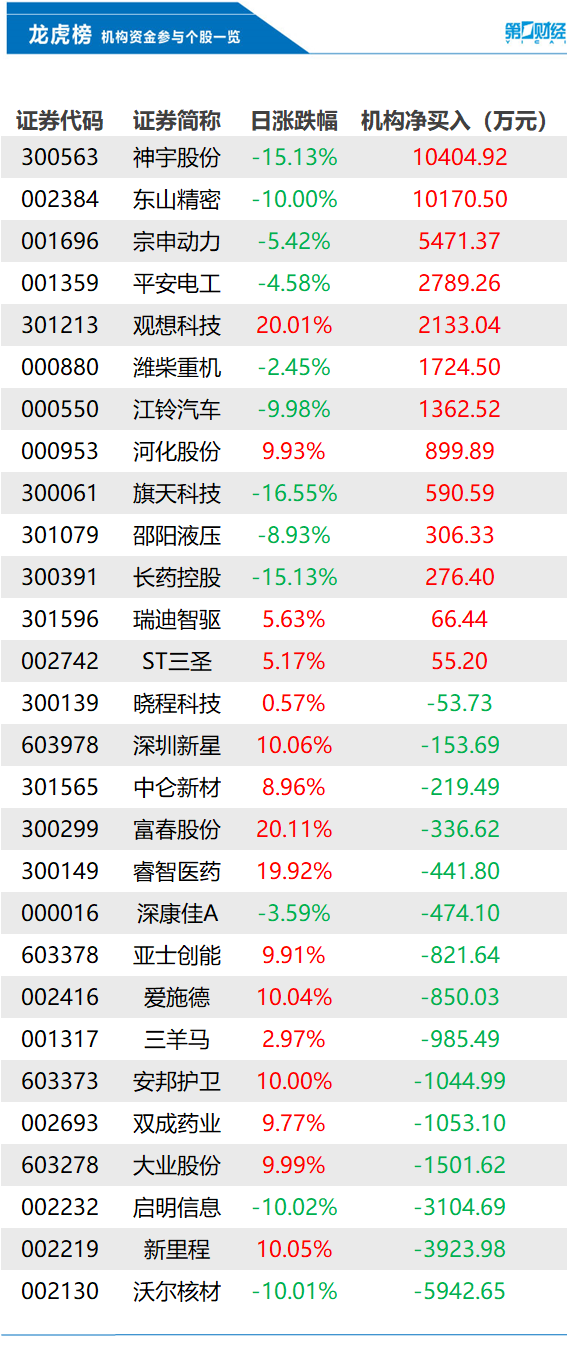
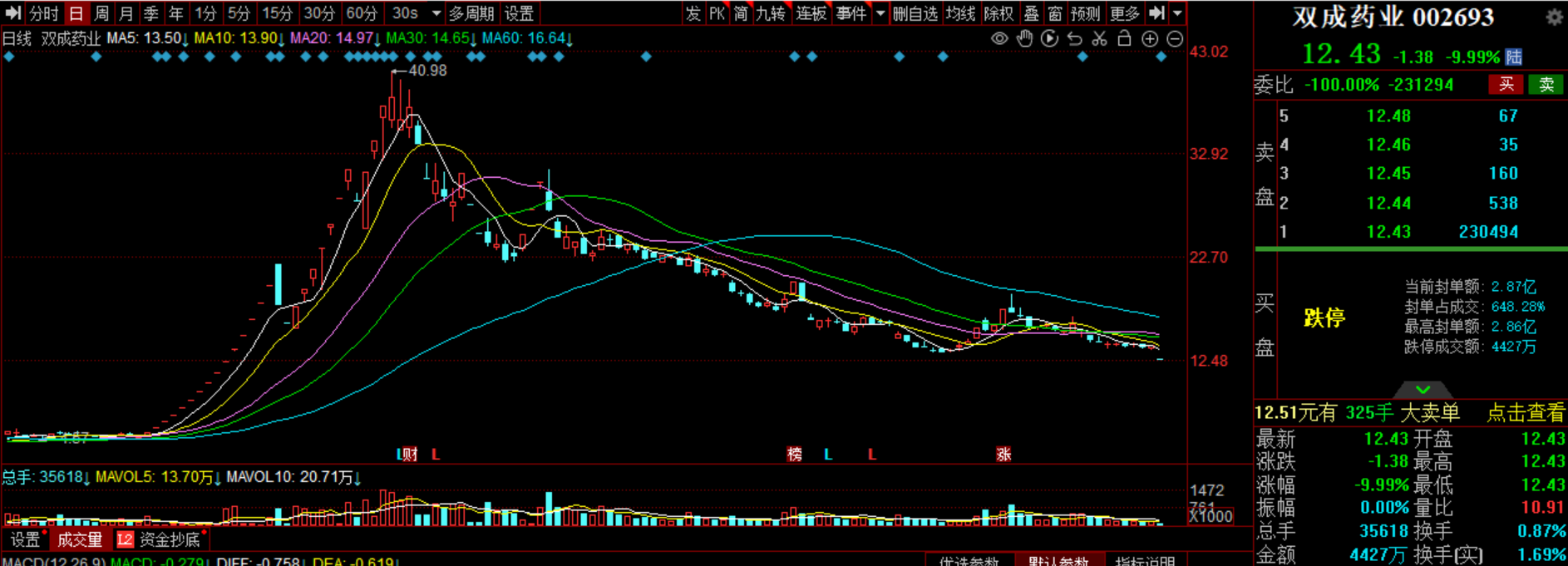
当天机构净买入前三的股票分别是神宇股份、东山精密、宗申动力,净买入金额分别是1.04亿元、1.02亿元、5471万元。盘后数据显示,8月5日龙虎榜中,共28只个股出现了机构的身影,有13只股票呈现机构净买入,15只股票呈现机构净卖出。当天机构净买入前三的股票分别是神宇股份、东山精密、宗申动力,净买入金额分别是1.04亿元、1.02亿元、5471万元。锤子财富2024-08-06 15:31:350000详解中国在WTO就美国新能源汽车补贴等措施提起诉讼
美方制定出台歧视性的补贴政策,扭曲了公平竞争,严重扰乱了全球新能源汽车产业链和供应链,违反了相关世贸规则。据商务部网站信息,3月26日,中国就美国《通胀削减法》有关新能源汽车补贴等措施诉诸WTO争端解决机制。据第一财经记者从权威信源处了解,目前,中国在WTO发起同美国的争端磋商案件编号为DS623,相关信息通报已于当地时间3月28日分发给WTO成员。锤子财富2024-03-31 03:51:520000第三季度净利润同比增长23%,百度美股盘前涨超2%
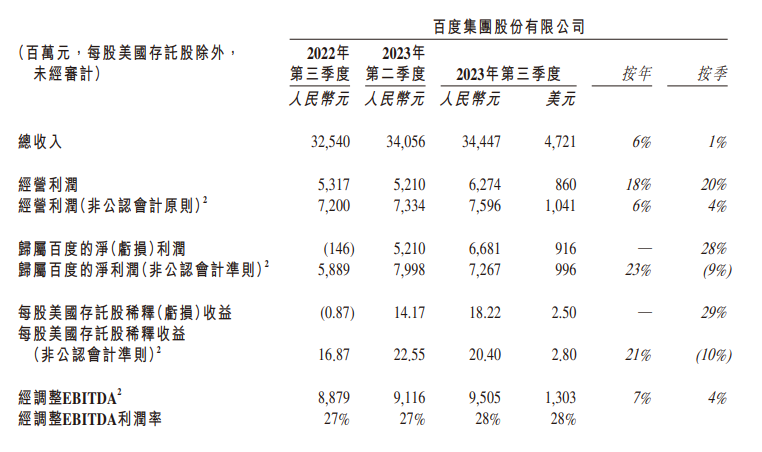
财报披露后,百度美股盘前涨超2%。截至今日收盘,百度港股收涨2.78%,报107.4港元。11月21日,百度发布第三季度财务报告,三季度营收达344.47亿元,同比增长6%;归属于百度的净利润(non-GAAP)达72.67亿元,同比增长23%。财报披露后,百度美股盘前涨超2%。截至今日收盘,百度港股收涨2.78%,报107.4港元。锤子财富2023-11-21 18:10:230000