全链条政策“灌溉”创新药械,长三角跨域协同如何发力?
创新药械企业发展的跨域协同路径怎么走?
“此次新政加大了对创新药和医疗器械的医保支付力度,其中,我们的达芬奇手术机器人等相关诊疗项目直接受益,可实行医保预算单列支付;同时,商业健康保险层面,部分基本医保保障范围外的自费手术机器人项目也得到了‘沪惠保’的报销补充。”在谈及上海日前出台的《关于支持生物医药产业全链条创新发展的若干意见》(下称《意见》)时,直观复星相关负责人这样对第一财经表示,“同时,期待上海探索建立长三角创新技术医疗服务价格项目同步试行机制,加快推进医疗服务价格项目一体化。”
作为另一家上海本土专注糖尿病领域创新药的企业,银诺医药相关负责人也告诉记者,《意见》对于创新药研发在不同阶段的临床试验给予了不同的现金补贴,补贴金额也较之前有了大的提升,这一措施非常“给力”,“建议一些诸如创新药品首发价格跨省份协同快速挂网等也可以在后续逐步推进。”
临床研究、医保支付政策优化
记者在调研中了解到,一些创新药械企业集中反映的,如医院临床端可及性不高、院内药事会召开频次低、创新药械占用DRG/DIP支付空间、临床研究时间漫长等问题,均在《意见》中得到纾解;其中,在临床研究、医保支付两方面,给予的支持力度较大。
1类国产创新药“华堂宁”的研发企业、华领医药创始人陈力告诉记者,上海从2022年开始就建立了《上海市生物医药“新优药械”产品目录》,华领医药在去年被列入其中。这意味着,对于进入“新优药械”目录的药品,如果进入国家医保目录,上海市医院需要在1个月内召开药事会,随后批准该药品进入医院使用,“华堂宁目前已经在上海100多家医院有销售,从三甲医院到社区医院都有覆盖。”
“再从此次新政看,支付层面,此次《意见》还提到针对创新药械实行医保预算单列支付,这体现了上海对创新药的支持;报销方面,上海对创新药的报销比例达到90%,高于全国水平;以华堂宁为例,上海患者1个月自费30元钱就可以用到华堂宁。”陈力称。
除了医保支付,临床研究也是创新药械企业的重点关注领域。记者从昊海生科方面了解到,《意见》在临床研究方面的支持政策,一方面有助于提高研究机构、研究者的积极性;另一方面,对于新适应症的开发、真实世界研究等支持,也有助于企业获得相关资助。
“由于创新药械的多中心临床试验一般都会跨省份开展,因此,希望多中心临床试验相关的伦理审查互认等,能够在长三角地区甚至全国范围内实现互认。”昊海生科相关负责人同时建议,对于创新药械企业的临床试验方案,期待有监管部门能进行前置审评或辅导,以免在最终注册申报时被审评员质疑且需要进行重大调整。
长三角跨域协同需求正在逐步体现。研发地在江苏苏州、商业化团队建在上海的帕母医疗,是心肺领域创新医疗器械的科创企业,企业相关负责人告诉记者,除了一系列在研发领域的跨前指导外,《意见》高度重视创新医疗器械的市场准入问题,并通过一系列措施鼓励医院优先采购和使用,“这可以让我们节省许多时间,更快被纳入医院的采购目录,加速产品入院进程。”
“人才供给、产业链上下游供给,也是创新药械企业发展的关键。”研发地在浙江杭州、人才和原料供应来自上海的矩正医疗相关负责人告诉记者,一方面,上海是生物医药产业人才的聚集地,人才跨域流动能为一些初创创新药械企业提供更广阔的资源、视野和合作伙伴数据库;另一方面,在长三角一体化背景下,人才住房等普惠政策也需要协同。而对于产业链布局,与创新药械企业相关的上下游供应商、经销商等,也应逐步纳入保障和协同范围。
跨域协同挑战
记者了解到,不少创新药械企业在长三角跨域协同层面仍有一些共同诉求,包括:跨域医院临床研究伦理互认,跨域医院内医疗服务项目价格统一,跨域市场准入和商业化等。
为此,上海市医学会医学研究伦理专科分会候任主任委员,复旦大学附属华山医院机构办主任曹国英告诉记者,长三角医院之间的伦理互认仍然存在一定堵点,尽管目前各家医院伦理委员会的审查流程较为规范,但审查质量仍有参差不齐。多中心临床试验中的牵头单位专业科室能力强,但伦理委员会审查能力不一定强,因此参加单位有可能不完全认可牵头单位伦理委员会的审查结果。
那么,有哪些解决路径?曹国英对此建议,第一,可以探索建立同一专病领域范畴内的医院伦理委员会联盟,推动伦理互认机制;第二,可以利用信息化系统,探索建立上海、江苏、浙江等地医院之间的伦理委员会联盟,推动当地的伦理互认机制;第三,可以利用信息化系统,在各地伦理互认机制基础上,探索建立长三角区域内医院之间的伦理委员会联盟,推动长三角区域内的伦理互认机制。
一位医保部门价格招采处人士也告诉记者,目前,创新药械的定价仍然应遵循市场规则,也就是说,企业对于其创新药品、创新医疗器械的定价有非常充分的自主权;同时,对于自评点数高和居中的新上市药品,按照批准状态给予首发价格1~5年不等的稳定期,稳定期内暂不会将其纳入集采范畴。
“但对于医院内的医疗服务项目,尤其是一些原本价格相差不大的服务项目,有望率先在经济发展水平、医保筹资水平较为接近的长三角区域实现价格统一。”该人士称。
对于跨域市场准入和商业化,健康中国研究中心理事梁嘉琳称,如果创新药的初创企业刚刚完成产品上市布局,区域准入方面人手严重短缺、人员能力不足,很难跟大中型制药企业竞争,应最大限度精简合并准入事项,最大限度降低初创企业的区域准入成本,“比如,可探索鼓励单病种的跨区域专科联盟建设,通过联盟内部医疗机构联合发布《药物临床路径专家共识》、统一用药名单(如:处方集)等方式,实现长三角地区同类医院的准入标准统一、准入结果互认。”
“值得注意的是,当下,由于部分创新耗材无法单独计价、体外诊断试剂则含在医疗成本当中,故而医疗服务立项与收费对其影响甚大。当前,长三角各地市的医疗服务价格项目类别、价格调整规则互不统一,未来应当探索在同等技术劳务贡献、健康产出贡献的基础上,形成跨区域统一的医疗服务价格基准。”梁嘉琳补充。
美团骑手大专以上学历占比24.7%?真相是这样的
此前出现过“中国有700万外卖小哥,硕士及以上学历占1%”的消息,后被辟谣。近期,有消息称,“美团公布骑手学历数据,美团骑手总量300万,大专以上学历占比24.7%,约74万,其中研究生6万人,本科生17万人。”第一财经从美团知情人士了解到,该消息并不属实,美团并不掌握骑手学历情况。此外,上述消息所说的骑手数据与真实情况有出入。锤子财富2023-06-08 16:01:010000星际魅族沈子瑜首次为极星“站台”,手机和汽车融合是大势?
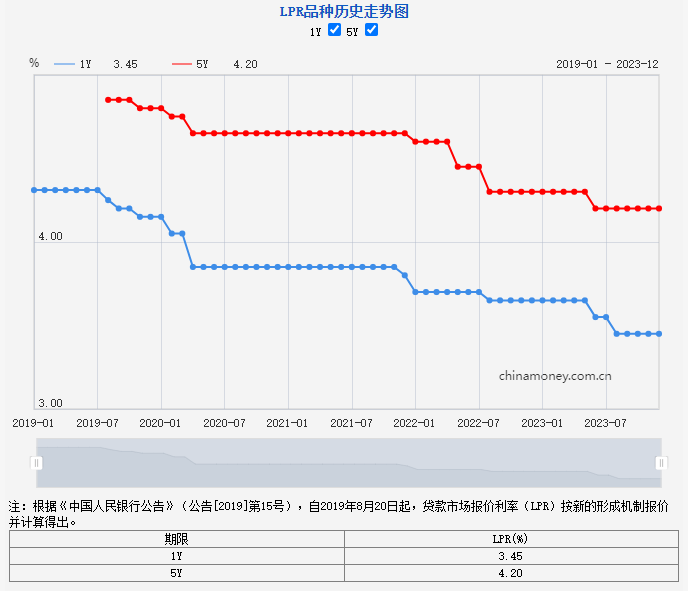
汽车和手机企业互相跨界已成大势。近日,在成都车展上,星纪魅族集团(下称“星纪魅族”)董事长兼CEO沈子瑜首次为极星汽车站台,并表示星纪魅族与极星汽车成立合资公司两个月以来,在智能软件系统上全力开发,已形成200人规模的软件团队。按照计划,极星4在成都车展上开启大定(大定指消费者在购车时需要支付的定金,一般不可退),将于今年年底开始交付,同时升级至PolestarOS系统。0000LPR报价连续四个月“按兵不动”,明年还有下调空间吗?丨火线解读
中国人民银行授权全国银行间同业拆借中心公布,2023年12月20日贷款市场报价利率(LPR)为:1年期LPR为3.45%,5年期以上LPR为4.2%。12月20日,新一期贷款市场报价利率(LPR)出炉,12月LPR报价维持不变,自8月实现非对称下调以来继续“按兵不动”。LPR报价“按兵不动”符合市场预期锤子财富2023-12-20 13:46:230000500亿元!互换便利首次操作落地,或撬动千亿级增量资金入市
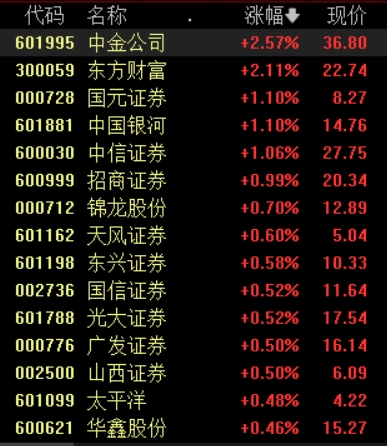
截至发稿,中金公司、东方财富涨超2%,国元证券、中国银河、中信证券等涨幅居前。10月22日早盘,证券板块盘中大幅拉升,截至发稿,中金公司、东方财富涨超2%,国元证券、中国银河、中信证券等涨幅居前。中金公司达成SFISF首笔质押式回购交易锤子财富2024-10-28 02:05:460000