国内首款新冠口服药获常规批准,对患者来说意味着什么
7月11日,先声药业(02096.HK)宣布,近日,国家药品监督管理局同意先诺欣(先诺特韦片/利托那韦片组合包装)由附条件批准转为常规批准,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。先诺欣成为国内首款获得常规批准的新冠口服药。
先诺欣是由先声药业与中科院上海药物研究所、武汉病毒研究所联合研发,具备自主知识产权的国产首款3CL靶点抗新冠创新药,于2023年1月28日附条件批准在国内上市,此后也被国家纳入医保报销目录。
截至目前,我国获批上市的新冠小分子口服药,具体是进口两款,国产四款,从作用的靶点上看,可以分为两大类,一类是3CL蛋白酶抑制剂,主要包括辉瑞的Paxlovid、先声药业的先诺欣以及众生睿创的乐睿灵(来瑞特韦);一类是RdRp抑制剂,主要包括了真实生物的阿兹夫定片、默沙东的莫诺拉韦胶囊以及君实生物的民得维。
先诺欣于2023年5月启动了国内首个针对已上市新冠口服药的大规模真实世界研究。研究由首都医科大学附属北京地坛医院副院长蒋荣猛教授牵头,研究课题为《在中国医疗卫生机构使用抗新冠病毒药物对新型冠状病毒感染疾病的治疗效果研究》,共有42家医疗机构参与,研究分析了3300多个新冠感染病例。
此前蒋荣猛曾表示,国内已上市多款新冠抗病毒药物,但尚缺乏大样本真实世界研究,也缺少大样本药物经济学评价、抗病毒药物头对头研究等,真实世界研究在回答科学问题的同时,能对传染病防治“关口前移”、降低疾病负担提供科学数据。
目前有市场人士对第一财经记者表示,原来已获批上市的新冠口服药,多数是附条件上市或者紧急获批,上市后仍需要开展研究,收集真实世界的使用数据,再证明药品有效性及安全性,原来药物主要在医院销售,才能收集到相关数据。现如今,有新冠口服药转为常规批准了,意味着可以在社会药房销售,有助于推动新冠口服药可及性,尽早让患者使用抗病毒药物进行治疗。
第一财经记者从先声药业了解到,此次先诺欣完全获批后,未来患者有望通过更多渠道便捷获得药品。
中基协新规来了!基金经理“中途跑路”套上了“紧箍咒"
“可在一定程度上遏制封闭期基金经理离职乱象”对于封闭期产品基金经理随意离职的行为,基民及渠道苦其久矣。更有甚者直接在公开渠道发布“小作文”,质疑基金经理在产品封闭期离职跑路后,转身又在新东家发行了一只3年持有期产品。“基金尚在封闭期,基金经理岂能一走了之”曾有基民对此有些愤怒和无奈,毕竟基民圈曾流行一句俗语“买基金就是买基金经理”。0002美股涨跌互现道指两连阴,ARM上市在即IPO定价51美元
2年期美债收益率回落至5%以下。*三大股指涨跌互现,纳指涨0.29%;*美国8月核心CPI增长4.3%,创22个月新低;*福特宣布混合动力F-150明年产量翻倍。周三美股走势有所分化,8月CPI数据略超预期,市场继续评估美联储政策前景。截至收盘,道指跌70.46点,跌幅0.20%,报34575.53点,纳指涨0.29%,报13813.59点,标普500指数涨0.12%,报4467.44点。0001平安新银保业绩超预期,综合金融“护城河”日趋稳固
近日,平安集团发布一季报。第一季度,寿险业务方面,代理人渠道、银保渠道等主要渠道新业务价值均实现正增长,其中银保渠道表现亮眼,一季度平安银行代理保险收入达13.18亿元,同比增长84%,新业务内含价值NBEV超同期3倍。这一大幅超出预期的数据引发行业以及分析师们的热议。0000沙特航空一客机降落时冲出跑道 无人员受伤
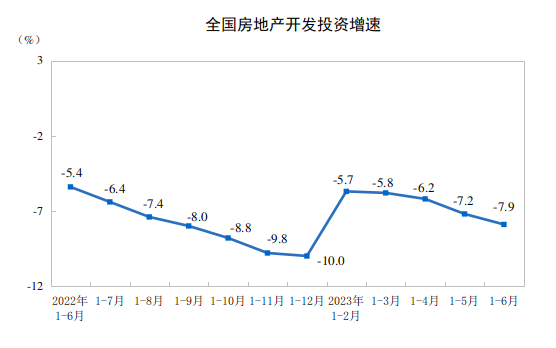
沙特航空发表声明称,机上乘客均已通过逃生滑梯安全疏散,没有造成人员受伤。飞机目前正在接受专家的技术评估。当地时间11日,一架从沙特首都利雅得飞往巴基斯坦白沙瓦的飞机在白沙瓦机场降落时,左侧主起落架冒烟,导致飞机冲出跑道。沙特航空发表声明称,机上乘客均已通过逃生滑梯安全疏散,没有造成人员受伤。飞机目前正在接受专家的技术评估。这架飞机航班号为SV792,为沙特航空飞机。0000统计局:上半年全国房地产开发投资58550亿元 同比下降7.9%
上半年,商品房销售面积59515万平方米,同比下降5.3%。一、房地产开发投资完成情况上半年,全国房地产开发投资58550亿元,同比下降7.9%(按可比口径计算);其中,住宅投资44439亿元,下降7.3%。锤子财富2023-07-17 10:45:200000