基因编辑疗法商业化提速,未来打一针就能治愈心脏病?
自去年12美国食品和药物管理局(FDA)批准了首个基因编辑治疗药物以来,基因编辑疗法临床在美国加速启动,未来有望看到更多疗法或适应证获得批准,从而能够让数以万计的患者受益。
美国FDA批准的首个基因编辑疗法是Vertex公司的一款基于CRISPR/Cas9基因编辑疗法产品CASGEVY,以及蓝鸟公司(Bluebird Bio)的一款基因疗法Lyfgenia,两款药物都用于治疗镰状细胞病(SCD),这是一种罕见的遗传性血液疾病。
基因编辑疗法商业化提速
Vertex预计其基因疗法在美国商业化后的首名患者将在未来几周内开始接受CASGEVY治疗;蓝鸟公司也表示,预计首名患者将在今年第一季度开始使用Lyfgenia。
与此同时,基因编辑疗法的发展进程仍在提速。上个月,Vertex Pharmaceuticals和CRISPR Therapeutics宣布,其合作开发的获得美国FDA批准,用于治疗12岁及以上的输血依赖性β-地中海贫血(TDT)患者,意味着这款药物的适应证范围进一步扩大。
本月,另一款针对遗传性血管性水肿(HAE)的基因编辑疗法在首次人体试验中展现出治疗潜力,患者的症状得到显著改善,许多人能够摆脱长期药物治疗并恢复正常生活。
遗传性血管性水肿是一种罕见疾病,由C1抑制基因突变导致患者血管渗漏。大约五万人中有一人患有这种疾病,通常会影响嘴唇、口腔、喉咙、肠道、手和脚。如果肿胀影响肠道,人们可能会卧床不起,还会导致面部毁容,最严重的致命影响是喉咙肿胀,可能导致窒息死亡。
十名患者参加了在英国、新西兰和荷兰进行的小型一期试验,每个人都接受了CRISPR基因编辑工具设计的“纳米脂质”注射,研究人员通过基因编辑技术敲除了激肽释放酶基因,从而阻止身体过度产生这种酶而导致肿胀。
从事这款基因编辑药物研发的美国奥克兰大学首席研究员希拉里·朗赫斯特(Hilary Longhurst)表示,单剂量疗法似乎可以永久治愈医院患者非常严重的症状,因为患者在接受治疗后的18个月内没有服用任何药物,但症状显著改善。
自2012年美国科学家詹妮弗·杜德纳(Jennifer Doudna)和法国科学家埃玛纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)发明了CRISPR-Cas9基因编辑技术以来,就掀起了基因治疗领域的一场技术变革。在全球范围内,三家主要的基因编辑生物技术公司分别为CRISPR Therapeutics、Intellia Therapeutics以及Editas Medicine。
基因编辑疗法的开发也离不开基因组学的发展。尽管许多遗传变异对健康没有影响,但仍有大量的基因突变可能与疾病风险相关,因此对于人类全基因的测序这有助于解释为什么某些特定人群比其他人群更容易患病,也有助于未来更多基因疗法的开发。
“未来所有的药物开发都应该基于基因检测,我们需要做更多的工作来了解新的基因突变如何导致各种疾病,通过对不同人进行基因测序,完善用于计算不同人患病的风险的方法。”一位中国的临床专家告诉第一财经记者。
目前获得批准或者等待批准的基因疗法大部分瞄准的是罕见病,这是由于罕见病的致病原因是基因突变,通过基因编辑来修复突变,有望实现一次性治愈的疗效;同时,在基因编辑安全性未确定的情况下,选择无药可治,生存期较短和生存概率低的罕见遗传疾病作为适应证,更有可能通过监管审批。
但如果基因疗法仅仅瞄准罕见病,意味着仅有一小部分患者能够享受到基因疗法的好处。在这一背景下,有研究人员正在针对更常见的疾病开发基因编辑药物,例如基因编辑降胆固醇疗法。
生物医药基金Loncar Investments创始人布拉德·隆卡(Brad Loncar)对第一财经记者表示:“基因治疗要满足人们非常高的期望,就必须要跳出罕见疾病领域,实现更大的商业价值。”
重写DNA,打一针修复心脏
美国宾夕法尼亚大学医学院心脏病学家、宾大佩雷尔曼医学院疾病遗传和表观遗传起源项目主任Kiran Musunuru教授正在领导一个利用治疗性基因编辑的方法来对抗心血管疾病的创新研究。
Musunuru发现了一种调节低密度脂蛋白(LDL)胆固醇的基因,这激发了多种针对与该基因途径相关的蛋白质的药物的开发。此前,他在实验室开发了使用被称为“基因剪刀”的CRISPR基因编辑技术修改肝脏基因的流程。他希望能够实现“打一针永久降低胆固醇水平,预防心脏病”的治疗目标。
目前Musunuru的实验性基因编辑降胆固醇疗法正在英国和新西兰进行临床试验,并已获得美国FDA的批准,很快将在美国开始试验。
进行试验的生物技术公司Verve Therapeutics在去年11月的美国心脏协会(AHA)会议上报告称,在参与该试验最早的三名受试者中,注射一次可以将血液中的低密度脂蛋白降低高达55%。
很多高胆固醇患者由于没有定期检查胆固醇水平,他们大多数人都不知道自己患有这种疾病,将会大大增加心脏病发作的风险。
据介绍,Verve已经进入临床试验的基因编辑药物是针对LDL水平高于200mg/d L左右的病情较轻的患者;针对LDL水平高于500mg/dL严重患者的药物版本仍在研发中。血液中的胆固醇进入冠状动脉壁后会形成斑块,当斑块破裂时,心脏病就会发作。
Verve的基因编辑疗法在基因编辑CRISPR技术的基础上,首次通过修改单碱基对DNA编辑,关闭了一个叫做PCSK9的基因。
碱基编辑技术由美国哈佛大学化学生物学家刘如谦团队开发,该技术改进了传统的CRISPR系统,可对基因进行非常精确地编辑,只需要修改DNA中的单个碱基,而不像其他基因编辑方法那样通过切断DNA的双链来引发细胞的自我修复。
PCSK9是近年来心血管药物热门的治疗靶点,该基因与LDL水平的关联被揭示后,制药巨头蜂拥而至,开发出靶向PCSK9的治疗药物,以及“打一针管半年”的长效降脂药。但Verve的基因编辑疗法,是希望从改变基因入手,只需注射一次,就能彻底降低胆固醇水平。
通过这种DNA碱基编辑技术,科学家们还致力于开发针对遗传性心肌病的疗法。来自英国、美国和新加坡的心脏病专家团队已经宣布,将联手为患者设计一种基因编辑疗法,通过重写DNA,开发全球首个用于治疗遗传性心脏病的药物。业内人士称,心血管医学的“决定性时刻”即将到来。
据介绍,研究团队将首次在心脏中使用碱基编辑技术,来关闭有缺陷的基因。此前的动物研究已经表明这些技术是有效的。这项研究获得了英国心脏基金会(BHF)3000万英镑的资助。
遗传性心肌疾病由基因缺陷造成,可能导致猝死或进行性心力衰竭,任何年龄段患者都会因此猝死。而且,所有患有遗传性心肌病的人都有一半的风险将这种基因突变传给他们的孩子,通常同一家庭的几个成员会出现心力衰竭、需要心脏移植或在年轻时死亡。
科学家们经过30年的研究,发现了许多导致不同心肌病的基因和特定的遗传缺陷,以及它们的致病机制。该团队研究人员表示,这种针对遗传性心肌病的基因疗法研究将在未来三年内进入临床试验。
美国哈佛医学院医学教授、CureHeart项目联合负责人克里斯汀·塞德曼(Christine Seidman)称DNA碱基编辑技术为“优雅的化学”,通过改变DNA的单个碱基,有望使心脏恢复正常的功能,从而在疾病发生之前起到预防作用。
不过目前这种在DNA水平上直接进行的基因编辑技术的发展尚未成熟,还面临耐受性方面的挑战以及对遗传性方面的长期评估。意大利圣拉斐尔生命健康大学医学院细胞和组织生物学、基因和细胞治疗教授路易吉·纳尔迪尼(Luigi Naldini)这样评价这种技术:“解决这项技术还有待一些关键领域的突破,我们还有很多工作要做。就耐受性而言,纳米颗粒的递送技术仍处于早期阶段,长期的影响也有待观察。”
根据美国FDA对基因编辑疗法的要求,公司必须对试验参与者进行长达14年的跟踪。这意味着任何一款基因编辑药物在上市之前,都需要提供严格的人体数据。
中国生物技术公司进展如何?
全球基因编辑疗法技术开展得如火如荼,中国相关领域的研究进展如何?第一财经记者注意到,尽管目前中国尚无基因编辑疗法药物获得审批上市,但相关的临床研究已经开始提速。
最新的重磅研究进展来自于上个月复旦大学附属眼耳鼻喉科医院(下称“上海五官科医院”)团队,该团队发表了关于基因疗法治疗先天性耳聋的最新临床数据,在国际上首次证明了基因治疗在遗传性耳聋患者临床治疗中的安全性和有效性,展现了基因治疗对治愈遗传性耳聋的应用潜力。
这项研究结果表明,在接受了一种基因药物治疗六个月后,六名患有严重OTOF基因突变耳聋患儿中,有五名出现了听力恢复和语言识别能力的改善。
不过该药物采用的并不是基因编辑技术CRISPR,也未采用DNA的递送技术,而是利用携带OTOF基因的aav双载体递送系统来恢复患者缺失基因的蛋白表达。目前,上海鼎新基因科技正在对该疗法进行商业化转化。
在对标已经获得美国FDA批准的Vertex公司的基因疗法CASGEVY方面,来自上海的邦耀生物也已经给出初步数据。“基因编辑追求的是一次性治愈,所以它是一项重要的技术变革。”邦耀生物董事长刘明耀表示。
邦耀生物在2023ASH年会上公布了实验性药物BRL-101的部分临床数据,显示截至2023年7月20日,10例输血依赖性β-地中海贫血患者经BRL-101基因治疗后全部得到治愈。不过这10例患者给药后平均随访时间仅有2年,长期效果还有待进一步评估。
邦耀生物副总裁、华东师范大学生命科学学院李大力教授表示,目前效率比较高的基因编辑技术是CRISPR-Cas9,但将基因编辑技术真正转化成药品来生产,现阶段还有一定距离。他认为,从理论上来讲,未来基因编辑技术能够治愈的疾病种类将会拓展。
一位从事细胞免疫研究的业内人士对第一财经记者表示:“从基因编辑技术方面来看,中国企业和美国的差距其实并不大,从Car-T时代开始,中国的技术发展就已经开始缩短和美国的差距。”
上述人士强调,制约中国基因编辑疗法发展的主要因素会有两个,第一是这些生物技术公司未来要想IPO融资,会变得非常困难,因为短期很难盈利,投资人要退出也面临障碍;第二是在支付端,医保可能很难覆盖价格如此高昂的基因细胞疗法。
安全性和可及性仍受长期挑战
基因疗法目前的定价十分昂贵,这也限制了药物的使用。以Vertex的CASGEVY为例,每位患者的治疗费用高达220万美元。而蓝鸟公司的Lyfgenia价格更贵,每位患者的治疗费用高达310万美元。
根据Vertex目前的药物制备能力,大约16000名镰状细胞重症患者将有资格获得该药物,这远远无法满足所有患者的需求。仅仅在美国,这种疾病患者人数就达到约10万人。
为此,美国卫生部门也在努力寻找方法,确保公平获得针对镰状细胞病的突破性、高成本的基因疗法。近日,拜登政府表示将与Vertex和蓝鸟公司就医疗补助计划进行谈判。
Vertex公司CEOReshma Kewalramani此前表示:“我们相信药品的价格能够反映其带来的价值,而这种价值所带来的价值是一次性疗法,可能终生治愈疾病。”
全球健康药物研发中心(GHDDI)主任丁胜此前分析称,与普通药物相比,基因治疗方式的前期研发有很高门槛,治疗基因的设计、优化乃至载体选择都不容易,而基因疗法的链条非常长,选择何种载体、何种片段的治疗基因、基因治疗过程中采用何种技术,每一个环节都需要根据患者的情况进行设计以及质检,才能保证安全,这就导致有些品种的药品难以批量化生产,生产成本居高不下。
基因疗法除了高昂的制备成本之外,涉及基因编辑的部分还面临严格的伦理风险。事实上,早在2015年4月,中山大学黄军就教授发表全球第一篇使用CRISPR-cas9基因编辑技术对人类胚胎中地中海贫血症致病基因修饰的研究成果,但被指挑战了伦理边界。
其中DNA编辑技术的一个最大的风险在于“脱靶”,所谓“脱靶”是指被错误进行基因编辑的细胞会留在体内,这是由于体内的基因编辑无法像体外基因编辑那样进行质量控制。
中国科学院脑科学与智能技术卓越创新中心研究员杨辉就评论称,DNA编辑药物效果很好,但具有“脱靶”风险,而且监管要求严格。他表示,现在已经有公司正在开发RNA编辑技术,这种基因编辑并非基于CRISPR系统,不会改变DNA序列,安全性自然要比DNA编辑好一些,但有效性可能没有DNA编辑那么强,仍然有待数据验证。
上个月,生物技术公司Ascidian一项针对ABCA4基因突变相关视网膜病变的RNA编辑疗法获得美国FDA批准进入临床,引发业界关注。公开信息显示,罗氏、礼来以及葛兰素史克(GSK)等跨国制药巨头均在布局RNA编辑基因疗法。
去年12月,美国生物技术公司Wave Life Sciences宣布其在研RNA编辑疗法WVE-006在一期临床试验中开始给健康志愿者给药,旨在治疗与α-1抗胰蛋白酶缺乏症(AATD)相关的肺部或肝脏疾病。GSK与Wave达成了为期四年的研发合作,Wave可能获得高达33亿美元的款项。在中国,辉大基因、博雅辑因、锐正基因等公司也都在开发RNA编辑疗法。
中兴通讯首席战略官王翔:安全穿越周期底部 在逆境中增长
11月2日,以“聚兴谋略智算未来”为主题的第三届中兴通讯战略峰会在深圳举行,来自运营商及政企客户、行业头部企业、咨询机构和知名高校的专家学者齐聚一堂,围绕宏观洞察、智算创新、数字化转型、咨询赋能等多个热点话题展开交流。锤子财富2023-11-07 12:27:380000钟南山:新冠抗体保护力在减弱,如何应对
钟南山表示,一旦感染新冠病毒,应该及时给予药物治疗,现在很多病人还没意识到及时用药的重要性。近期,全国发热门诊监测结果显示,“五一”期间部分地区新冠疫情出现小幅上升。锤子财富2023-05-15 18:56:350000北京气象局:本次降雨为140年来最大降雨
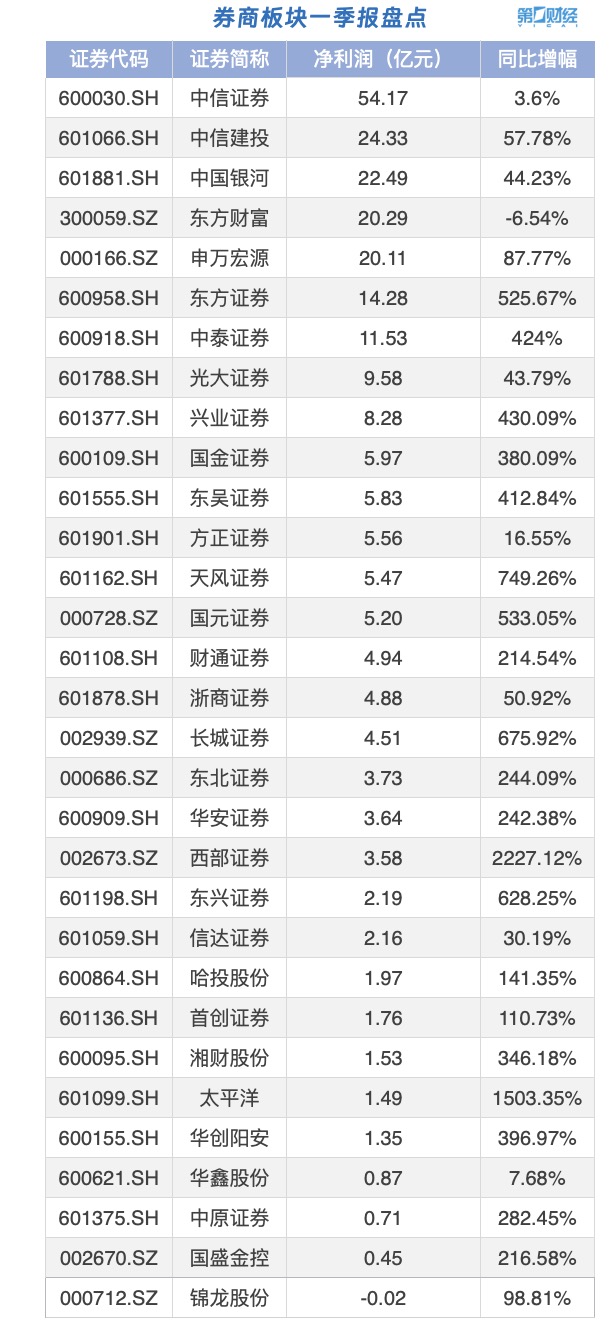
本次降雨天气过程记录到的降雨量极值出现在昌平的王家花园水库,为744.8毫米。8月2日,北京市气象局官方微博消息,2023年7月29日20时至8月2日07时,北京出现极端强降雨天气,本次降雨天气过程记录到的降雨量极值出现在昌平的王家花园水库,为744.8毫米。中国古代虽然也有像“晴雨录”这样的天气记录,但主要是以文字记录天气现象及其产生的影响为主,并没有准确的数据记录。锤子财富2023-08-02 11:21:070000行业一季报盘点|券商股走强 多家券商一季度业绩报喜
4月27日,券商板块午后上攻,截至收盘,国金证券涨超4%,兴业证券涨超3%,中金公司、西部证券涨超2%。盘后,中信证券、中信建投、兴业证券、浙商证券、中国银河等近10家券商的一季报业绩悉数出炉,其一季度净利均较上年同期实现增长。锤子财富2023-04-27 23:20:090000